 Структура белков. Предполагаемая функция JUNQ состоит в рефолдинге и/или деградации белков. Скорость синтеза белков выше у прокариот и может достигать 20 аминокислот в секунду.
Структура белков. Предполагаемая функция JUNQ состоит в рефолдинге и/или деградации белков. Скорость синтеза белков выше у прокариот и может достигать 20 аминокислот в секунду.
В начале XIX века уже были получены некоторые сведения об элементарном составе белков, было известно, что при гидролизе белков образуются аминокислоты. В 1836 году Мульдер предложил первую модель химического строения белков. Согласно представлениям Мульдера, каждый белок состоит из нескольких протеинных единиц, серы и фосфора.
Мульдер также исследовал продукты разрушения белков — аминокислоты и для одной из них (лейцина) с малой долей погрешности определил молекулярную массу — 131 дальтон.
В конце 1880-х гг. русский учёный А. Я. Данилевский отметил существование пептидных групп (CO—NH) в молекуле белка. В 1894 году немецкий физиолог Альбрехт Коссель выдвинул теорию, согласно которой именно аминокислоты являются основными структурными элементами белков. В начале XX века немецкий химик Эмиль Фишер экспериментально доказал, что белки состоят из аминокислотных остатков, соединённых пептидными связями.
Сложность выделения чистых белков затрудняла их изучение. С помощью методов биоинформатики стало возможно не только обработать данные рентгеноструктурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности. Белки обладают свойством амфотерности, то есть в зависимости от условий проявляют как кислотные, так и осно́вные свойства. Примером таких белков служат гистоны и протамины.
Растворимость белка определяется не только его структурой, но внешними факторами, такими как природа растворителя, ионная сила и pH раствора. Как правило, белки достаточно стабильны в тех условиях (температура, pH и др.), в которых они в норме функционируют в организме.
Денатурация в некоторых случаях обратима, как в случае осаждения водорастворимых белков с помощью солей аммония, и используется как способ их очистки. При синтезе белка на рибосоме первым (N-концевым) аминокислотным остатком обычно является остаток метионина, а последующие остатки присоединяются к C-концу предыдущего.
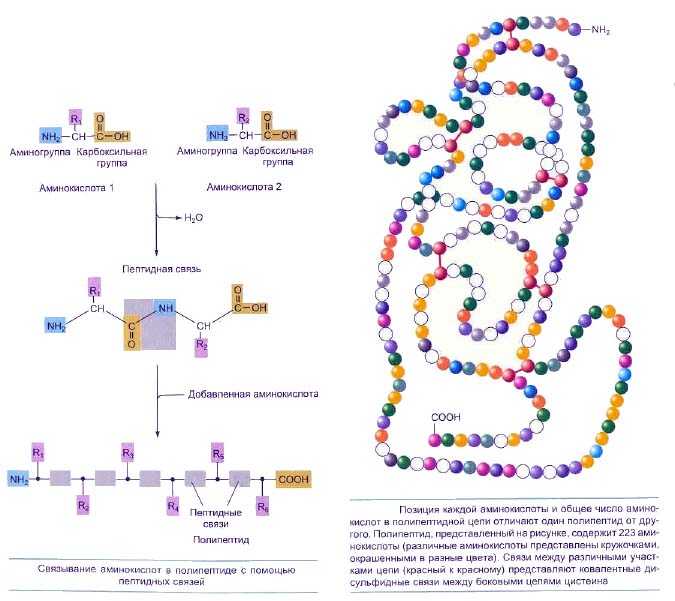
К. Линдстрём-Ланг предложил выделять 4 уровня структурной организации белков: первичную, вторичную, третичную и четвертичную структуры. Важными особенностями первичной структуры являются консервативные мотивы — устойчивые сочетания аминокислотных остатков, выполняющие определённую функцию и встречающиеся во многих белках.

По степени гомологии (сходства) аминокислотных последовательностей белков разных организмов можно оценивать эволюционное расстояние между таксонами, к которым принадлежат эти организмы.
0,34 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Разные способы изображения трёхмерной структуры белка на примере триозофосфатизомеразы. Рассмотрим для примера один из характерных мотивов строения белков.
Белки в обмене веществ
Известно, что мотивы укладки являются довольно консервативными и встречаются в белках, которые не имеют ни функциональных, ни эволюционных связей. Определение мотивов укладки лежит в основе физической, или рациональной классификации белков (такой как CATH или SCOP). Для определения пространственной структуры белка применяют методы рентгеноструктурного анализа, ядерного магнитного резонанса и некоторые виды микроскопии.
Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной.
Глобулярные белки — водорастворимы, общая форма молекулы более или менее сферическая. Мембранные белки — имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны в межклеточное окружение и цитоплазму клетки.

Белки-транспортёры специфичны, каждый из них пропускает через мембрану только определённые молекулы или определённый тип сигнала. Помимо пептидных цепей, в состав многих белков входят и неаминокислотные группы, и по этому критерию белки делят на две большие группы — простые и сложные белки (протеиды). Простые белки состоят только из полипептидных цепей, сложные белки содержат также неаминокислотные, или простетические, группы.
Физические свойства белка в клетке с учётом водной оболочки и краудинга макромолекул(англ.)русск. Рибосомный синтез белков принципиально одинаков у прокариот и эукариот, но различается в некоторых деталях.
Простые и сложные белки
В рибосомах белки всегда синтезируются от N- к C-концу. NRS-синтаза обычно состоит из нескольких доменов или отдельных белков, осуществляющих селекцию аминокислот, образование пептидной связи и высвобождение синтезированного пептида. Короткие белки могут быть синтезированы химическим путём с использованием методов органического синтеза, например, химического лигирования. После завершения трансляции большинство белков подвергается дальнейшим химическим модификациям, которые называются посттрансляционными модификациями.
Посттрансляционные модификации могут регулировать продолжительность существования белков в клетке, их ферментативную активность и взаимодействия с другими белками. В ряде случаев посттрансляционные модификации являются обязательным этапом созревания белка, в противном случае он оказывается функционально неактивным.
Другой распространённой модификацией является гликозилирование — считается, что около половины белков человека гликозилировано. Один и тот же белок может подвергаться многочисленным модификациям. Так, гистоны (белки, входящие в состав хроматина у эукариот) в разных условиях могут подвергаться более чем 150 различным модификациям.
Из ЭПР в аппарат Гольджи, а оттуда в лизосомы и на внешнюю мембрану или во внеклеточную среду белки попадают путём везикулярного транспорта. Поддержание правильной пространственной структуры белков принципиально для их нормального функционирования.
Агрегация белков является характерным признаком старения организма. В процессе эволюции клетками было выработано четыре основных механизма для противодействия агрегации белков. Аутофагия и накопление неправильно свёрнутых белков в особых немембранных органеллах характерны для эукариотов. В настоящее время общепризнана теория о том, что стабильная конформация белка обладает минимальной свободной энергией по сравнению с другими возможными конформациями этого полипептида.
Роль белков в организме и, соответственно, их строение весьма разнообразно. В изоэлектрической точке гидратация и растворимость белка минимальны. К концу XIX века было исследовано большинство аминокислот, которые входят в состав белков. Такой мотив обнаруживается примерно в 10 % белков.




